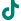普利制药纳米创新药PLAT001获得中国药物临床试验批准通知书
昨日,海南普利制药股份有限公司发布关于创新药注射用PLAT001获得药物临床试验批准的公告。

纳米创新药PLAT001
PLAT001是普利制药和浙江大学联合创制的First-in-class的纳米创新药,首次构建了γ-谷氨酰转肽酶(GGT)介导的电荷反转聚合物,并将其应用于抗肿瘤药物的递送,突破纳米药物在实体瘤中的渗透性瓶颈。
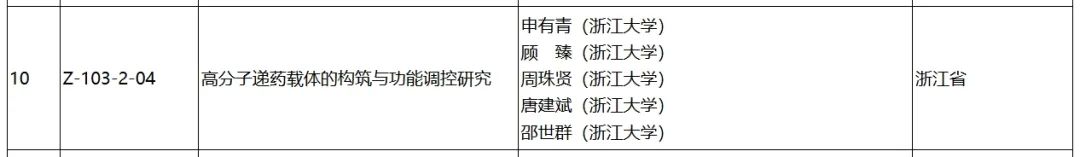
普利制药创新药注射用PLAT001开发后,相继提交了美国和中国药物临床申请,属于共线生产品种。今年初,PLAT001获得美国FDA临床试验批件,是我国自主研发的首个在美国获批临床试验的纳米药物。今年4月,PLAT001核心专利荣获海南省专利优秀奖。6月24日,浙江大学“高分子递药载体的构筑与功能调控研究” 项目获得2023年度国家自然科学奖二等奖,PLAT001项目为该项目重要部分。
实体瘤,顾名思义是能用眼睛直接看到的肿瘤:通过临床检查如x线摄片、CT扫描,B超、或触诊扪及到的有形肿块称实体瘤。如乳腺癌、肺癌、肝癌、胃癌等,实体瘤占恶性肿瘤90%以上。
恶性肿瘤是威胁我国居民健康的主要疾病之一。国家癌症中心最新发布《2022年中国恶性肿瘤流行情况分析》显示,2022年新发恶性肿瘤:482.47万例;恶性肿瘤总体发病率:208.58/10万,发病前5位的恶性肿瘤是:肺癌(106.06万例,22.0%)、结直肠癌(51.71万例,10.7%)、甲状腺癌(46.61万例,9.7%)、肝癌(36.77万例,7.6%)和女性乳腺癌(35.72万例,7.4%)。
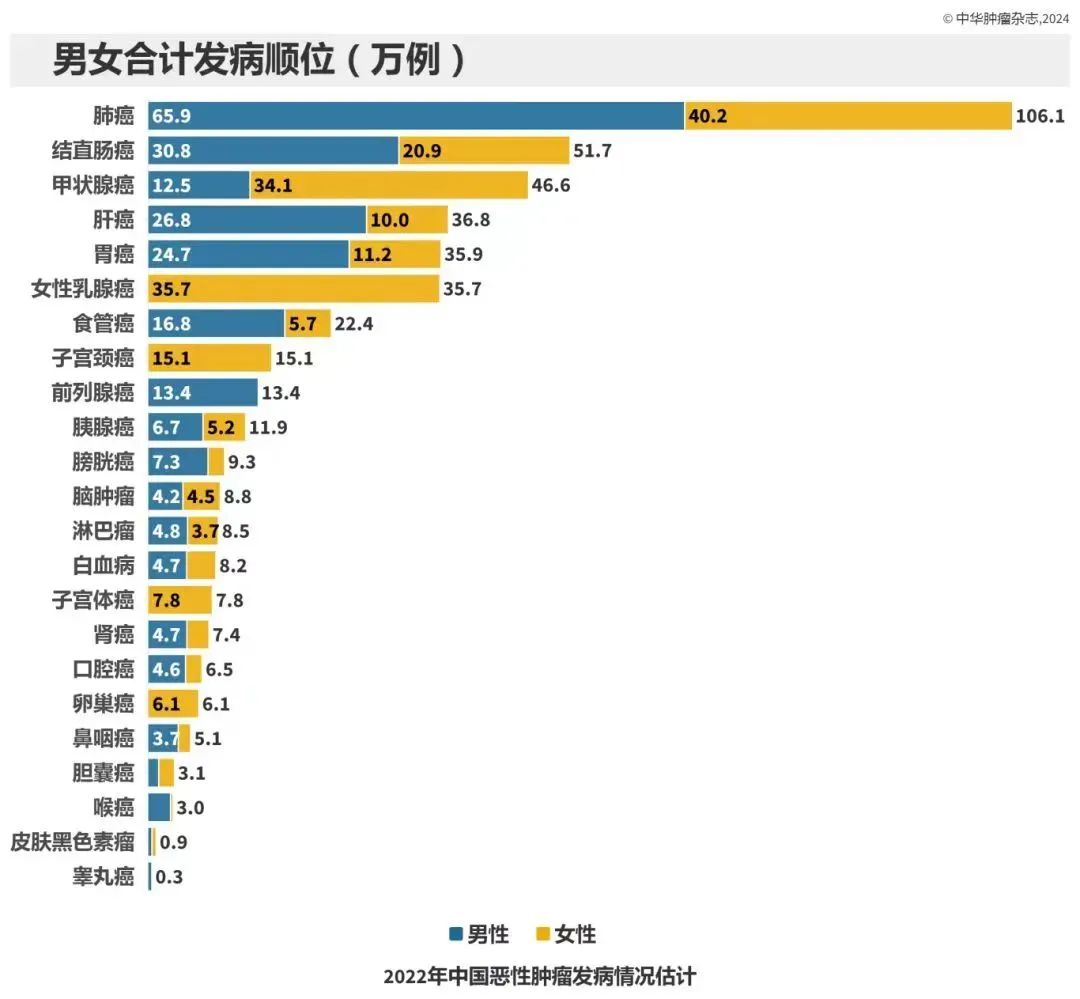
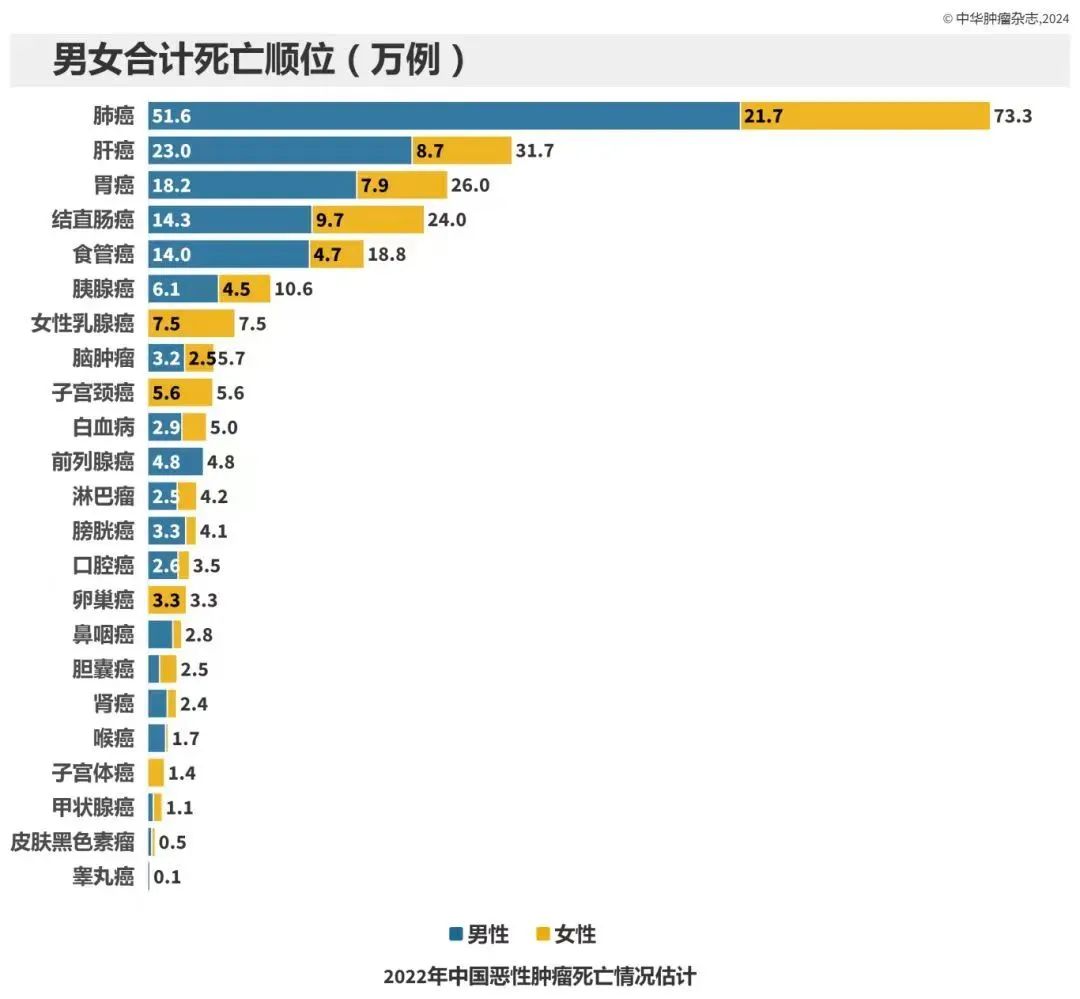
2022年我国恶性肿瘤死亡病例:257.42万。死亡病例数前五:肺癌(31.65万例,12.3%)、肝癌(31.65万例,12.3%)、胃癌(26.04万例,10.1%)、结直肠癌(24.00万例,9.3%)和食管癌(18.75万例,7.3%)。PLAT001的研发将为晚期或转移性实体瘤患者的治疗提供新的选择。
创新药注射用PLAT001的药物临床试验批准通知书,标志着普利制药具备在中国开展本品临床研究的资格,标志着普利制药进入到生物医药、纳米科技、新材料等新领域。创新药注射用PLAT001的研发将丰富公司肿瘤治疗领域产品,并对公司拓展肿瘤治疗领域的市场带来积极影响。
纳米药物进入快速发展阶段,目前,包括美国食品药品监督管理局和欧洲药品管理局在内的全球药品监管机构,已批准多种纳米药物上市,这些纳米药物广泛应用于肿瘤、传染病、心血管等疾病的治疗。
另外,全球有多种纳米药物正处于临床试验阶段。在2016年至2020年期间,全球进行了566项关于纳米药物的临床试验,其中172项在中国进行,尤其在2019年后,中国成为全球新增临床试验项目的主要贡献者,占比近一半。这表明中国纳米药物的研发和转化进入了加速发展阶段。
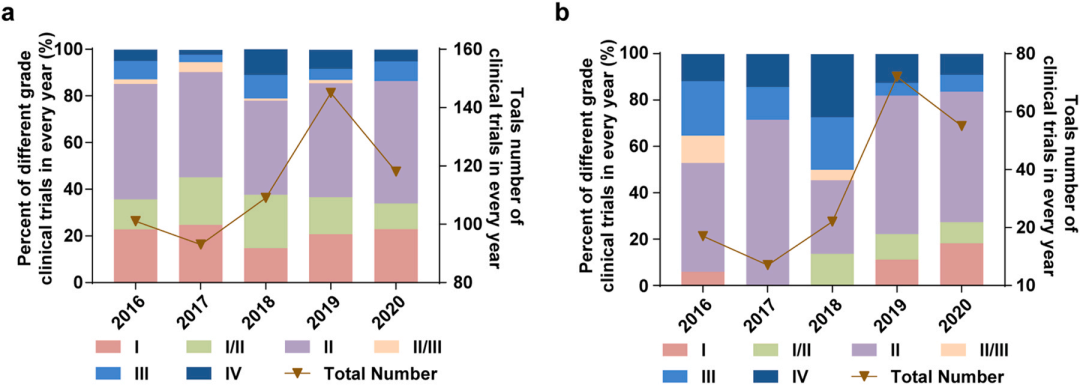
2016年至2020年,全球(a)和中国大陆(b)的纳米纳米药物的临床试验分布。左y轴表示总试验的比例,右y轴表示总试验次数。
来源:Wang, Shuhang et al. Nanoparticle-based medicines in clinical cancer therapy. Nano Today (2022).
据EMERGEN research的纳米药物市场报告,2021年全球纳米药物市场规模为538.5亿美元,预计在预测期内收入年复合增长率为7.4%,到2030年全球纳米药物市场可达1024亿美元。
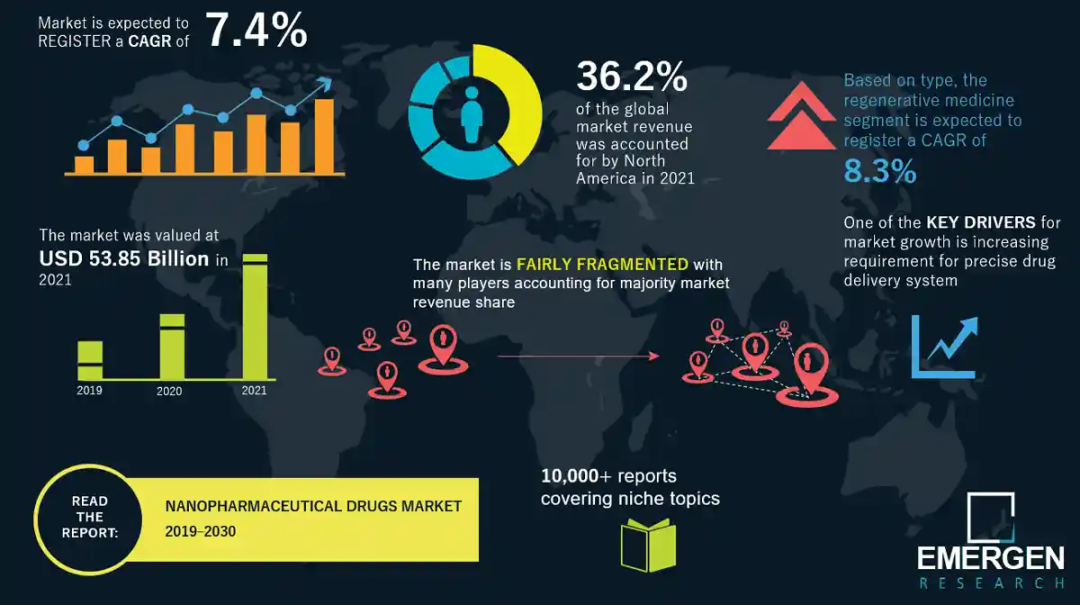
来源:https://www.emergenresearch.com/cn/industry-report/nanopharmaceutical-drugs-market
海南普利制药股份有限公司1992年成立于海口,是中国医药制剂国际化先导企业和国家工信部智能制造示范企业,已被国家工信部纳入工业转型升级中国制造2025年儿童药重点项目企业。2017年创业板上市后,短短3年已成为中国上市公司科技创新百强企业。

PLAT001既是First-in-class的项目,又具有平台型的复制意义,是普利制药在创新药领域全球布局的一个重要里程碑。公司将尽快开展本品的临床试验研究,推动这一药物的快速上市,实现公司创新药双报出海的战略布局,让一款有突破性治疗意义的药物尽快地让国内外患者获益。
未来,普利制药将一如既往地实施“先进高端制造, 立足国内,面向国际”的战略,持续不断地开发更多更好的药物供应全球,为民族医药工业的壮大持续作出贡献。

 首页
首页