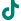海南普利制药股份有限公司(以下简称“普利制药”或“公司” )全资子公司浙江普利药业有限公司于近日收到了美国食品药品监督管理局(以下简称“FDA”) 签发的创新药注射用PL002的药物临床试验批件,现将相关情况公告如下:

产品基本情况
(一)产品名称:注射用PL002
(二)适应症:本品拟用于原发性肝癌患者的术前诊断及术中导航。
(三)剂型:注射剂
(四)规格:40mg
(五)持有人:浙江普利药业有限公司
双模态造影剂PL002
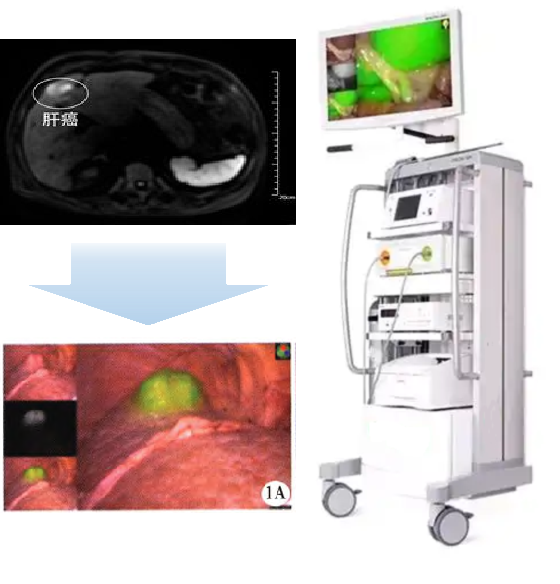
PL002是浙江普利药业有限公司研发的荧光/磁共振双模态造影剂,开发荧光/磁共振双模态造影剂成为提高原发性肝癌手术效率的有效方案。双模态造影剂的荧光成像能力可用于肝癌术中荧光导航,而磁共振增强能力可用于在术前判断肝脏代谢能力,推测肿瘤及肝脏对造影剂的摄取情况,提高肿瘤诊断精度,降低术前规划难度。
PL002相较于吲哚菁绿具有明显优势。目前吲哚菁绿在临床使用中存在给药到手术时间不确定的问题,可能造成病灶与正常组织对比度不足,影响术中的病灶的判断,PL002采用独特的钆络合物与荧光分子共价键结合的分子结构设计,这种设计能够让医生在术前通过磁共振成像确定造影剂在病灶中的聚集情况,进而针对患者个体情况来对手术时间进行规划。同时,由于PL002体内更为稳定,在荷瘤小鼠模型中同等条件下荧光成像效果维持时间长于现有荧光造影剂,也保证了其在临床应用中具有更宽的手术窗口。
使用双模态造影剂可以为手术医生提供更加丰富的诊断信息,降低术中的决策压力,避免过度切成,增加发现微小病灶的可能性,最终实现患者的全面获益。此外,相较于传统荧光造影剂,PL002的安全性更高、体内更为稳定,成像效果更佳,为其临床使用提供了有效的支持。
目标全球市场,提前布局出海
作为中国“造影剂创新药的引领者”,普利制药一直致力于造影剂创新药的研发。注射用PL002的成功研发将丰富公司造影剂领域产品,并对公司拓展造影剂市场带来积极影响。此次创新药注射用PL002美国药物临床试验的获批,是公司“创新药出海”的第一站。同时,公司注射用PL002其他市场的新药临床试验申请工作也在持续推进中。
普利制药始终致力于创新药的研发,以满足临床患者需求为己任。这次获得美国FDA的IND批准,是对公司研发实力及产品质量的高度认可。这不仅标志着普利制药在造影剂创新药的研发及国际市场拓展上取得了重要突破,也为全球肝癌患者带来了新的希望。在未来的发展中,普利制药将继续为全球患者提供更多、更好的创新药物,为人类的健康事业做出更大的贡献。

 首页
首页