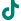免疫疗法创新药取得可喜成果,美国创新药企业Imunon加强与普利合作
海南普利制药股份有限公司与美国一家领先的创新药企Imunon,Inc.,展开了一项深入的合作,助力CDMO的一种新型免疫疗法药物,用于卵巢癌的治疗。
卵巢癌是指生长在卵巢上的恶性肿瘤,全球每年新增确诊病例超过30万,中国每年新增确诊病例超过6万,居世界首位。
(卵巢癌年新增确诊病例情况)(Annual new confirmed cases of ovarian cancer)
由于卵巢癌早期缺少症状,即使有症状也不特异,筛查的作用又有限,因此早期诊断比较困难,就诊时80%已为晚期(III/IV),而晚期病例又疗效不佳,5年内的死亡率超过60%,死亡率超过宫颈癌及子宫内膜癌之和,高居妇科癌症首位。
几十年来,卵巢癌的标准治疗方案一直停滞不前,手术和化疗是卵巢癌治疗的主要手段。手术治疗方面,中晚期患者应进行肿瘤细胞减灭术以最大程度切除肉眼可见的肿瘤。化疗方面,一线化疗以紫杉醇联合卡铂为首选。此外,用于维持治疗的靶向药物(抗血管生成药物:贝伐珠单抗、PARP抑制剂:奥拉帕利、尼拉帕利)也为卵巢癌治疗提供了更多的选择。
尽管做出了这些努力,但总体生存率(OS)的改善仍然难以实现。
美国创新药企业的新型免疫疗法药物有可能突破当今标准一线治疗方案,成为第一个也是唯一一个卵巢癌免疫疗法。
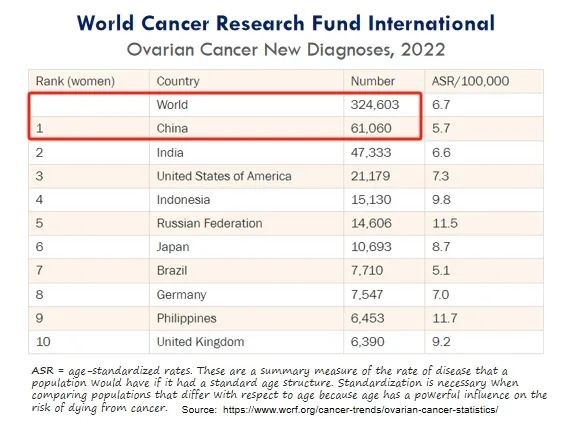
白细胞介素12(IL-12)是免疫反应对抗癌症的核心,可以激活免疫系统对肿瘤进行攻击。Imunon开发的新型免疫疗法药物IMNN-001其纳米颗粒特征可使细胞转染,可局部、可持续地输送IL-12以支持免疫系统对抗卵巢癌,避免了早期工业界尝试利用IL-12时观察到的系统性毒性。
在之前的合作中,普利制药向美国合作伙伴提供了高质量的临床批样品,这些样品已被用于早期临床试验中,且取得了优异结果。
基于双方对彼此专业能力的高度认可和信任,双方已进一步扩大合作范围,以实现更大的协同效应。普利制药将承担该新药项目新制剂工艺改进工作,并继续承担后续临床样品生产任务。
2期临床试验结果达业内领先水平
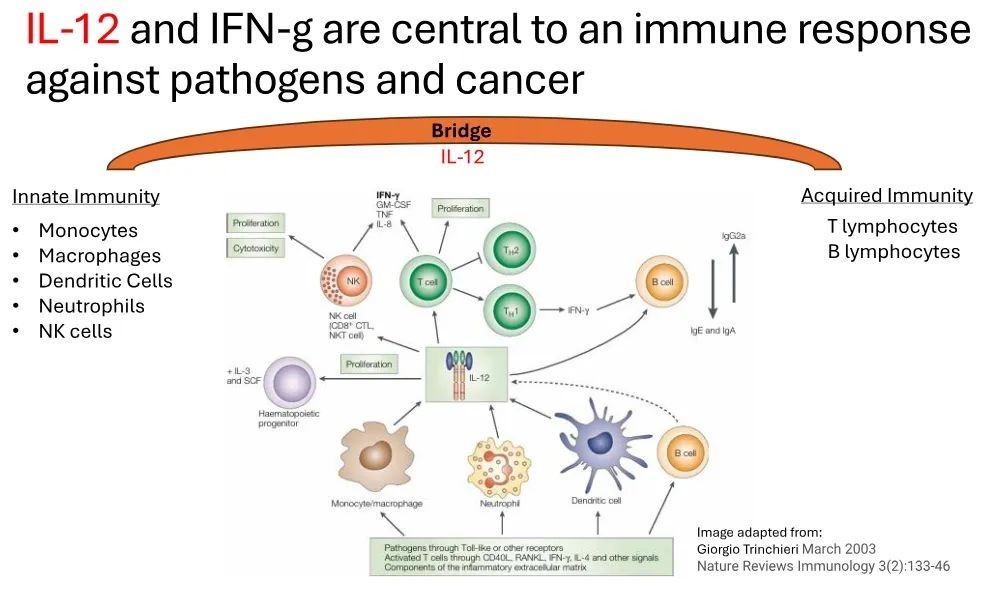
近期,IMNN-001的2期临床试验结果已被公布,这种新型免疫疗法药物在治疗组中的表现显著优于标准治疗方案,如果在3期临床试验成功,预计将取代标准治疗,成为新的首选一线治疗方案。研究结果如下:
1)与单独采用标准治疗相比,意向治疗人群 (ITT) 的中位总生存期 (OS) 增加11.1个月。其中,对于接受了PARP抑制剂治疗的人群,IMNN-001组的患者的中位OS尚未达成(试验组仍然有很多患者存活,因此无法计算出一个确切的中位OS值,这种情况通常表明试验组的治疗效果较好),其中部分女性患者存活已经达到5年。与标准治疗组相比,这些女性使用IMNN-001治疗的总生存期(OS)提高了144%。
2)接受≥3剂新型免疫疗法药物治疗的患者的中位 OS 增加了15.7个月。
3)与单独的标准治疗相比,PFS (无进展生存期)有3个月的改善。
鉴于以上积极的临床试验结果,合作双方对3期临床试验和商业化都充满了信心。



(Imunon公司合作伙伴到访普利浙江杭州基地,并表示感谢和对公司的认可)
(Visit Hangzhou Site (Zhejiang) )



Swipe right to view more(Imunon公司合作伙伴到访普利海南海口基地,同公司人员一同参观实验室、工厂等)
(Visit Haikou Site (Hainan) )
此外,在该新药通过临床试验并获得相关监管部门的批准后,普利制药将负责该药的商业化生产,确保药品能够顺利进入市场,满足广大患者的需求。通过此次合作,双方将共同推动该新药项目的成功开发和市场推广,为更多的患者带来福音。
未来,该药品有望在中国进行申报,双方将进一步合作共同开拓中国市场。同时,普利制药也将努力推动该药物在海南博鳌乐城国际医疗旅游先行区的落地(位于海南自贸港东南边陲小镇博鳌的乐城先行区拥有独一无二的特许政策:国家允许进口使用已在境外上市、但未在中国批准注册的药品和医疗器械,让国人不出国门就能享受国际前沿医疗服务),将创新药引进中国,造福国内患者。

普利制药 1992 年成立于海口,是中国医药制剂国际化先导企业和国家工信部智能制造示范企业,已被国家工信部纳入工业转型升级中国制造 2025 年儿童药重点项目企业,2023年海南普利通过海关“AEO”高级认证。
此前,海南普利及其子公司浙江普利、安徽普利也曾多次顺利通过美国FDA、欧盟EMA现场审计。作为中国医药制剂国际化先导企业,普利制药多年来一直恪守全球较高质量标准,是国内为数不多的原料药和注射剂研发和生产平台,也是为数不多的同时获得美国、中国、欧盟等药监部门批准的原料药、关键辅料、药物药剂和GMP中间体CMO/CDMO的优质供应商。

 首页
首页