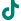普利制药于近日收到美国食品药品监督管理局(FDA)签发的苯磺顺阿曲库铵注射液的上市许可。这是普利制药今年收到的第12张美国ANDA。普利制药的苯磺顺阿曲库铵注射液(20mg/10ml)已于2024年3月获得FDA签发的上市许可,近日,苯磺顺阿曲库铵注射液新增规格(10mg/5ml 和200mg/20ml)获得FDA上市许可。

这标志着普利制药生产的苯磺顺阿曲库铵注射液(多规格)同时具备了在美国上市销售的资格,可满足个体化剂量的不同要求,将对公司拓展美国市场带来积极影响。

苯磺顺阿曲库铵注射液的FDA批件,是普利制药今年的第十二张ANDA。普利制药在获批速度和数量上,在国内医药企业中处于领先地位。
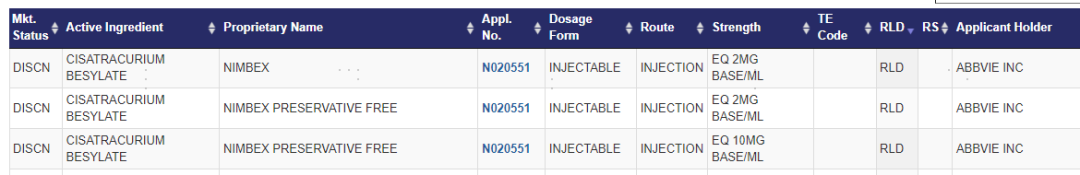
全规格获批满足临床个体化需求。苯磺顺阿曲库铵注射液具有个体化剂量要求,需要在使用过程中监测神经肌肉功能。与原研Abbvie 规格一致,20mg/10ml、10mg/5ml 、200mg/20ml的全规格,能够更好地满足不同患者的个体化剂量需求。
FDA官网:原研Abbvie顺苯磺阿曲库铵获批规格截图
海南普利制药股份有限公司1992年成立于海口,是中国医药制剂国际化先导企业和国家工信部智能制造示范企业,已被国家工信部纳入工业转型升级中国制造2025年儿童药重点项目企业。2017年创业板上市后,短短3年已成为中国上市公司科技创新百强企业。

公司从事药品国际化开拓以来,共有42个产品在美国、欧洲以及东南亚等国家成功注册,已获得了160多个国际制剂上市许可,产品远销世界各地。未来,普利制药将一如既往地实施“先进高端制造, 面向国内国际”的全球战略,持续不断研发更多更好的药物;走向世界,为民族医药工业的强大持续作出贡献,让中国老百姓用上出口欧美的高品质健康品。
欢迎垂询 共拓美国市场
Welcome for enquiry, cooperation
陈女士:ccm@hnpoly.com

 首页
首页