2024年5月22日,海南普利制药股份有限公司旗下的全资子公司浙江普利药业有限公司(以下简称“浙江普利”)于近日收到了国家药品监督管理局(以下简称“NMPA”)签发的比拉斯汀口崩片临床试验批准通知书,此次比拉斯汀口崩片临床试验的获批,成为国内该品种首家取得临床试验批件的企业,这标志着浙江普利在儿童药的研发上再次取得了重要突破,丰富了儿童药研发管线并将对拓展中国市场带来积极影响!

比拉斯汀口崩片
《中国慢性荨麻疹(CU)专病管理与抗组胺药物应用现状白皮书》显示,96.10%医师初诊考虑使用含二代抗组胺药物的治疗方案;《中国荨麻疹诊疗指南(2022版)》指出对于儿童患者,无镇静作用的第二代抗组胺药是一线选择,若不得已选用或联合其他抗组胺药,应关注镇静类抗组胺药对患儿学习的影响。
比拉斯汀是一种新型第二代非镇静性的长效抗组胺新药,具有选择性外周H1受体拮抗剂亲和力,对毒蕈碱受体无亲和力,无心脏毒性,口服给药吸收迅速,具有良好的耐受性、安全性和较高的生物利用度。且对于肾脏功能不全、肝脏功能不全患者无需调整用量。除了不具有镇静作用外,比拉斯汀还不会导致体重增加、抗胆碱作用或心脏副作用,尤其在嗜睡和疲劳方面有显著改善。

比拉斯汀口崩片由FAES FARMA,S.A.公司研发,最早于2017年6月12日经HMA互认可程序在德国批准上市(商品名为Bilaxten,规格为10mg),随后在欧盟26个经济成员国上市。在欧盟国家,本品临床安全性、有效性得到充分证明,比拉斯汀的疗效已在成人和青少年及儿童中进行了研究,已证明体重至少为20公斤的6至11岁儿童适用于该产品,属儿童专用药。
原研比拉斯汀片在国内上市后,国内仿制药企业迅速跟进,且原研的比拉斯汀口崩片还未在国内上市。浙江普利的比拉斯汀口崩片成功研发后,提交了临床试验申请,并于近日收到了NMPA所签发的比拉斯汀口崩片药物临床试验批准通知书,成为国内该品种首家取得临床试验批件的企业。本品适用于儿童,这标志着浙江普利在儿童药的研发上再次取得了重要突破,丰富了儿童药研发管线并将对拓展中国市场带来积极影响,也将为荨麻疹及其他过敏性皮肤病提供新的用药选择!
争做高端儿童药引领者,普利制药于1992年成立与海南海口,一直以“让中国老百姓用上出口欧美的高品质健康品”为宗旨,致力于成为国内高品质药品领军企业,多年来积极响应并实践国家关于支持儿童药等各类相关政策。
浙江普利药业有限公司是工信部国家科技重大新药创制的儿童药基地、儿童药物研发与产业化联盟首批核心成员企业、杭州市高新技术研发中心,目前已承担国家科技重大专项“儿童用药品种及关键技术研发”的8个项目开发,儿童药基地已被纳入工信部2016年工业转型升级—中国制造2025儿童药重点项目,并成为中国儿童药物研发和产业化联盟首批联盟成员。

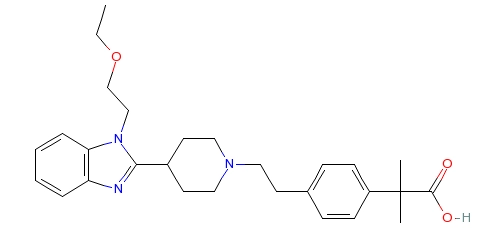
普利制药目前已成功开发出:地氯雷他定干混悬剂、阿奇霉素干混悬剂、伏立康唑干混悬剂、氟康唑干混悬剂等儿童药;其中地氯雷他定干混悬剂已获得德国、荷兰批准,阿奇霉素干混悬剂、伏立康唑干混悬剂、氟康唑干混悬剂均已获得美国FDA上市许可。另外还有12个儿童药即将上市,填补国内诸多儿童用药空白,并且将在中美欧同时申报,在推动高品质国产儿童药走出去的同时,更让国内儿童用药达到与欧美地区同等的精准给药水平,争做面向国际的高端儿童药引领者!

 首页
首页